Antoine Lavoisier se vuelve un referente al hablar de ciencias como la química, la biología o incluso en temas de economía. Este personaje francés es catalogado como el «gran padre de la química moderna» tras sus trabajos y estudios que marcaron notablemente estas distintas ciencias, en especial la química.
Su nacimiento se remonta al 26 de agosto de 1743 en París, Francia, lugar donde marcaría una carrera digna de recordar. Su padre fue el abogado Jean Antoine Lavoisier, quien logró tener el cargo de procurador en el tribunal de justicia de última instancia de Francia. Este era nativo de Villers – Cotterets en Picardía, sin embargo, tendría que sustituir a su tío en el tribunal, llevándolo a mudarse a París.
Emilie Punctis fue su madre, quien descendió de una familia purista, aunque su nexo con Antoine Laurent de Lavoisier duró hasta los 5 años tras fallecer. Desde ese momento la vida del científico comenzó a cambiar, dando destellos de inteligencia que hacían notar su gran futuro.
Table of Contents
Un mundo lleno de estudios para Antoine Lavoisier
Los estudios de Antoine Lavoisier se desarrollaron en el College Mazarino, donde fue adquiriendo sus primeros fundamentos científicos y su formación humanística. Al salir, en 1754, la influencia de su padre lo llevó a estudiar derecho en la facultad de derecho de París.
Fue ahí donde consiguió graduarse como licenciado en 1764, a pesar de también haber estudiado Ciencias Naturales, que era su pasión.
Estos estudios de ciencias lo llevaron a recibir clases de botánica de Bernard de Jussieu y de física con el abad Nollet. Por otro lado, quien lo formó en química fue Laplanche y Guillaume Francois Rouelle, mientras que en mineralogía fue Jean Étienne Guettard.
La vida de Antoine Lavoisier a los 21 años era dedicada a los estudios y la ciencia, algo poco común entre los de su generación. A esta edad presenta un proyecto para alumbrar a toda París, lo que deja muestra el gran pensamiento que tenía, logrando un premio al mejor estudio.
Su primer aporte dentro de la química llega en 1765, cuando muestra dos informes relacionados al yeso que se usaba para blanquear casas en París. En ellos mencionó que existe diferencia entre el yeso cristalizado y el yeso en polvo, la cual es la cantidad de agua de hidratación.
El amor toca las puertas para Lavoisier
A los 28 años llega el amor para Antoine Lavoisier, tras conocer a la también química Marie Anne Pierrette, con quien se casaría en 1771. Con ella terminaría de forjar un paso importante en la química, llevándolos a ser reconocidos con los títulos del padre y la madre de la química moderna.
Marie Pierrette se convertiría luego de su matrimonio en su mejor acompañante y colaboradora, quien traduciría al idioma inglés gran parte de sus trabajos. Hay que destacar que la boda fue el 16 de diciembre de 1771, donde Antoine tenía 28 años y Marie apenas tenía 14 años.
Marie Anne Pierrette y la lucha por destacar
La vida de Marie no fue para nada fácil, ya que a los 14 años recibió una propuesta del Conde de Amerval para casarse. Este triplicaba su edad, algo que su padre rechazaba totalmente, por lo que estaba incluso dispuesto a casarse con ella para no forzarla a estar con el Conde.
En medio de esto, Antoine Lavoisier apareció como un joven noble de 28 años que era abogado y además ya tenía una trayectoria reconocida. Sus trabajos y su gusto en común por la química llevaron a Marie Pierrette a casarse con quien sería su gran pareja de vida y trabajo.
Con su matrimonio transcurriendo y con el crecimiento de Marie, su gusto por la química se fue ampliando, llevándolos a tener una gran relación. Claramente, esto para ambos se volvía más que una relación amorosa, una de trabajo y crecimiento para dejar un legado con los conocimientos que tenían.
Fueron los colegas de Antoine Lavoisier, Jean Baptiste Bucquet y Philippe Ginembre, quienes instruyeron a Marie Pierrete en la química. Gracias a ellos era mayor el tiempo que pasaba la pareja dentro de laboratorios, trabajando juntos para lograr nuevos aportes a la ciencia.
Las bases de la química moderna nacen en las letras de Marie
Luego de que Antoine Lavoisier fuese enjuiciado y posteriormente ejecutado en 1794, la vida de Marie cambió por completo, llevándola a ser muy solitaria. Todos los bienes que poseía con su esposo le fueron confiscados, incluyendo el laboratorio de trabajo que ambos tenían y donde pasaron juntos gran parte del tiempo.
Sin embargo, esto no detuvo a Marie y logró reunir mucha información importante y cuadernos de notas con documentos que mostraban el legado de su esposo. Gracias a estos documentos logró publicar el libro Memorias de Química de Lavoisier, donde quedaron instauradas las bases de la nueva química moderna.
Dentro de estas publicaciones, Marie aprovechó para publicar los trabajos de calor y formación de líquidos, además de las ideas de combustión, aire, ácidos y otros estudios. También aprovechó el prefacio de las publicaciones para atacar a los revolucionarios que llevaron a Antoine Lavoisier a su muerte, aunque finalmente no fueron publicados.
Aunque mantuvo el apellido Lavoisier durante toda su vida, tuvo un segundo matrimonio que no fue fructífero y que terminó en otra separación. Finalmente, esta gran científica y denominada madre de la química moderna, falleció en París el 1836 a los 78 años de edad.

Grandes aportes de Antoine Lavoisier
Durante su vida, el padre de la química logró instalar su propio laboratorio para realizar sus estudios. Junto a su esposa trabajó arduamente para lograr descubrir cosas importantes. Ella tomaba las notas y las traducía al inglés, muestra de ello el Ensayo sobre flogisto.
Para 1768 el científico logró pertenecer a la Academia de Ciencias tras presentar distintos artículos y trabajos en los que se hacían análisis de muestras de agua. Todo este avance en su vida solo le abrió las puertas al reconocimiento para que pudiese ocupar distintos cargos públicos, donde se incluyen algunos como:
- Director estatal de los trabajos que llevaban a la fabricación de pólvora (1776).
- Director de la Academia de Ciencias (1785).
- Miembro de la comisión que buscaba conseguir un sistema uniforme de pesas (1789).
- Comisario del tesoro (1791).
Además de esto, con sus conocimientos en economía, Antoine Lavoisier se encargó de crear reformas dentro del sistema monetario y tributario de Francia. Claramente la visión era la de buscar mejoras en distintos ámbitos y llevar al país a un nivel mucho más elevado con todos sus aportes.
Trabajos a los que dedicó muchas horas de concentración
Uno de los trabajos a los que más dedicó tiempo fue a la experimentación química de estequiometría con el peso de reactivos y productos. Todo esto lo hacía con un recipiente sellado de vidrio con el que logró demostrar que la cantidad de materia siempre es la misma en una reacción química.
Estas demostraciones que Antoine Lavoisier realizaba junto a su esposa, lograron un avance significativo dentro de la ciencia y la química. Además, de poder lograr descubrir la composición del agua tras darle nombre a los componentes que esta tenía y que hoy conocemos como oxígeno e hidrógeno.
Otro de los grandes aportes de este científico pasa por su examinación de la combustión, donde logra demostrar que ocurre tras la combinación de oxígeno y otra sustancia. Con esto lograría desplazar la teoría del flogisto que se conocía hasta entonces y demostraría la importancia que tiene el oxígeno en los seres vivos.
Tres de las grandes obras de Antoine Lavoisier
Entre las obras más notables de este químico se encuentran:
- El Tratado elemental de química (1789), donde explica que una sustancia simple no se puede dividir con métodos de análisis químicos. Además, dentro de esta publicación se encuentra su teoría sobre la formación de compuestos a través de los elementos.
- Memoria sobre la combustión (1777) donde explica lo antes mencionado sobre su aporte y descubrimiento.
- Consideraciones generales que tienen relación con la naturaleza de los ácidos (1778).

Colegas que también contribuyeron en su éxito
Hay que destacar que, aunque Antoine Lavoisier ha sido reconocido por sus grandes avances y aportes a la química, también ha contado con grandes colegas. Además de su esposa, quien nunca lo abandonó en sus trabajos dentro del laboratorio, también se vieron involucrados otros colaboradores para sus grandes obras.
Uno de ellos fue el matemático Pierre Simon Laplace, quien acompañó a Lavoisier a encerrar a un cobayo en un espacio de vidrio durante 10 horas. Gracias a este experimento pudieron determinar la cantidad de dióxido de carbono que se producía y la cantidad de oxígeno que se consumía.
Además de esto, también lograron descubrir que el hombre consume más oxígeno en actividad que en reposo, dando pasos importantes en la biología. Fue con estos estudios que se pudo determinar la importancia del oxígeno en los seres vivos, además de su influencia dentro del calor corporal que se tiene.
Durante el camino, no solo en su influencia y estudios, sino que, en sus trabajos, el apoyo que siempre tuvo Antoine Lavoisier fue el indicado para seguir. Es por ello que varios de sus logros se encuentran también bajo la colaboración de personajes de renombre dentro de la ciencia y la química.
La combustión y respiración animal también fue objeto de estudio de Lavoisier
Como mencionamos anteriormente, fue junto a Laplace que Lavoisier se encargó de estudiar la combustión y la respiración en los animales. Esto era algo que ya venía desarrollando Jan Ingenhousz con experimentos relacionados a la purificación del aire con plantas gracias a la luz.
Por su parte, Antoine Lavoisier se vio interesado en este tipo de temas, mezclando su interés por el conocimiento de la combustión. Todo esto lo llevó a realizar el experimento que ya mencionamos, donde junto a Laplace encerró a un cobayo para estudiar su respiración.
Además de esto, el experimento fue llevado a humanos para poder determinar cómo ocurría la respiración junto la combustión en el intercambio de gases. Dentro de su grupo de trabajo se encontraba Armand Seguin, quien se prestaba para los experimentos por amor a la ciencia.
Gracias a todo esto, Antoine Lavoisier logró conseguir demostrar que la combustión de carbono y oxígeno es la fuente del calor animal. Además, también logró determinar lo que mencionamos con relación al mayor consumo de oxígeno cuando los animales aumentan el trabajo físico.
La respiración y la fotosíntesis bajo sus primeros conceptos
Para la respiración, Lavoisier propuso una teoría en el que explica que el aire que entra al cuerpo se quema en los pulmones. Esto no fue bien visto por los principales científicos, por lo que el trabajo que seguía realizando Ingenhousz tomó valor después de la muerte de Lavoisier.
Fue Jan Ingenhousz quien se encargó de adoptar las ideas de Antoine Lavoisier con relación a los gases, proponiendo su propia hipótesis. Este planteó que las plantas no cambian el «mal aire» por el «buen aire» para solo hacer el mundo habitable.
Su hipótesis se basaba en que la planta absorbe el carbono del dióxido de carbono y desprende el oxígeno libre, mientras se alimenta del carbono.
Es así como Lavoisier influye en Ingenhousz con sus experimentos para que este descubra el rol que tiene la luz en la fotosíntesis. Fue así como Jan logró determinar el trabajo de la luz junto al CO2, agua y oxígeno, para que ocurriese la fotosíntesis adecuadamente.
El nacimiento de la nueva nomenclatura
Actualmente la nomenclatura que conocemos en química es parte del trabajo que realizó Antoine en 1787 junto a varios de sus colegas que le tendieron la mano. Entre los involucrados en este nacimiento de la nueva nomenclatura se encuentran: Guyton de Morveau, Claude Berthollet y Francois de Fourcroy.
En conjunto, se encargaron de eliminar o desplazar los términos o expresiones antiguas que se usaban para ciertos elementos. Partiendo de esto, fue Antoine Lavoisier quien se encargó de ordenar y agrupar en un laboratorio a estos personajes para poder presentar este proyecto importante.
Toda esta nomenclatura se presentó dentro del nuevo Método de nomenclatura química, la cual se presentó en la Academia de Francia en 1787. Sin embargo, no fue hasta 1789, en la publicación del Tratado elemental de química en 1789, donde se logró dar el paso decisivo y final para su aprobación.
Un trabajo efectivo para la nomenclatura por parte de Antoine Lavoisier
Robert Boyle fue el encargado de introducir el primer concepto de elementos y compuestos dentro de la química, pero gracias a Lavoisier nació la nomenclatura. Dentro de esta, además se encargó de agregar elementos como el oxígeno, hidrógeno y el nitrógeno, denominaciones que consiguió crear Antoine con sus trabajos.
Estas denominaciones son importantes y para la época fueron un gran avance, tras encontrarse dentro de dos de los elementos vitales como son agua y oxígeno. Además de esto, también se pueden incluir dentro del trabajo al azufre, fósforo y los metales, lo que desplazó a la ya mencionada teoría del flogisto.
Otra de las cosas que llegaron con esta nomenclatura, es la clasificación como compuestos a los ácidos fosfóricos y sulfúricos, así como de los óxidos metálicos. Una muestra real de que todo el trabajo que realizó Antoine Lavoisier realmente ha influido en lo que conocemos en la actualidad dentro de la química.
El nacimiento de los ácidos y los óxidos
Con esta nueva nomenclatura, Lavoisier y sus colegas fueron dividiendo a los compuestos en dos grupos, donde unos eran binarios y los otros ternarios. Partiendo de esto, se logran reconocer de la siguiente forma:
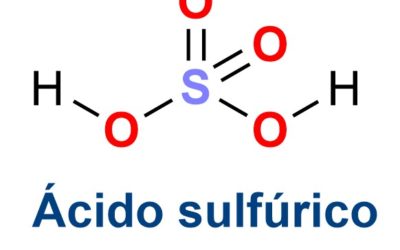
- Los ácidos: Estos se encuentran dentro de los binarios y toman una palabra que es la terminación «ácido» y otra particular según el elemento. Ejemplo de estos el ácido sulfúrico. La terminación «ico» u «oso» dependería de la cantidad de oxígeno que tengan.
- Los óxidos: Estos son los compuestos oxigenados de los metales que van en contra de los ácidos, quedando su nombre real. Ejemplo de esto el óxido de Cobalto.
Gracias a la publicación del Tratado elemental de química se puede establecer una fecha para la fundación original de la química moderna que conocemos hoy. Ese libro se convierte en la máxima referencia del trabajo fuerte que estuvo haciendo Antoine Lavoisier en su laboratorio junto a su esposa y colegas.
El calor fue objeto de estudio también
No solo la nomenclatura se ha destacado entre sus aportes, sino que también se suman estudios que realizó al calor con ayuda de Pierre Simon Laplace. Con distintos experimentos, ambos personajes lograron encontrar y fijar los distintos principios fundamentales de la termoquímica y que hasta hoy se conocen.
Uno de estos principios es el descubrimiento de que para descomponer un compuesto se necesita la misma cantidad de calor que cuando se formó con sus elementos. Aunque esto fue al comienzo una idea descabellada, no fue hasta la década de 1830 cuanto Germain Henri Hess, químico ruso-suizo, que desarrolló la investigación.
Cada cosa lograda por Antoine Lavoisier parece superar a la otra, ya que el legado y los aportes que consiguió siguen siendo utilizados hoy en día. Solo es muestra de la inteligencia y el talento que tenía por una de las cosas que más amaba, la química.
La teoría calórica en manos de Lavoisier
El nacimiento de esta teoría parte de la definición de los diferentes comportamientos físicos que tiene el calor y sus características. En esta, el calor se relacionaba más como fluido, que se encargaba de rodear toda la materia, siendo el responsable principal del calor que tenga.
La teoría del calor según Antoine Lavoisier se relacionaba con las moléculas que tiene cada cuerpo y que se encuentran en equilibrio. Gracias a ese «calórico» con el que cuentan los cuerpos, va a ver influenciado el estado en el que estén, ya sea que se hallen en la forma de un gas, un líquido o un sólido.
El contacto sería el principal conductor calórico entre cuerpos y seres vivos, donde inclusive se presenta en las quemaduras de piel por congelación. Esto referente a lo mencionado, de que un cuerpo necesita la misma cantidad de calor que tuvo en su formación para su deterioro. Es decir, tanto al momento de entrar como al momento de salir del cuerpo el calórico, ocasiona el mismo daño.
El calórico se desprendería del cuerpo a través de las llamas, donde es visible, aligerando su peso y dejando mucho menos restos. Con esto Antoine Lavoisier lograba un paso importante en la termodinámica, donde incluso se explicaban los experimentos realizados por James Prescott Joule.
El peso de la teoría se fue perdiendo
En su comienzo, y con las demostraciones de Lavoisier, la teoría tomó mucha popularidad, siendo aceptada por todo el campo de la ciencia en ese momento. Pero, poco a poco y con el pasar de los años la teoría se fue debilitando tras no encontrar respuesta para ciertas cosas.
Para Antoine Lavoisier, el calórico se encontraba en todo el universo de manera constante, lo que lo hacía pasar de cuerpos calientes a los que son más fríos. Incluso, fue Lavoisier junto a Laplace quienes utilizaron uno de los primeros calorímetros para conocer los cambios del calor con respecto a agentes químicos.
Gracias a estos experimentos se lograron hacer cálculos que se basaban en el calor que está latente, algo que se había visto anteriormente en las manos de Joseph Black. A partir de estos trabajos se le dio inicio a la termoquímica, donde nacen los experimentos basados en el calor con relación a las reacciones químicas.
Para el final del siglo XVIII nace la teoría cinética, la cual está relacionada con el comportamiento y las características macroscópicas de los gases. Está hipótesis se sumó a la calórica, pero lo cierto es que era, por mucho, más moderna. Además, contaba con el apoyo de la teoría atómica, donde se explica la combustión y la calorimetría de una mejor forma.
Es así como poco a poco su valor fue desapareciendo a mitad del siglo XIX. Actualmente, al calor se le considera como una energía que se encuentra en tránsito, donde está cumpliendo las leyes de la termodinámica.
Un pensamiento que fue quedando en el olvido
Cuando aparece Lavoisier en el mundo de la química, este aún se seguía rigiendo bajo el legado de la filosofía griega y los cuatro elementos. Caso contrario a lo ocurrido con la física, la cual había alcanzado su punto máximo con el aporte de Isaac Newton un siglo antes.
Para el momento solo se manejaba el concepto del flogisto, el cual fue elaborado en el siglo XVIII por Georg Ernst Stahl, un científico de Alemania. Esta teoría se basaba en que cada componente inflamable tenía flogisto, algo que se desprendía de ellos y se iba al aire aliviando su peso.
Basado en esto, se estudiaban los restos de los elementos que eran quemados y mientras menos residuos quedaban, más flogisto se liberaba según Stahi. Esto claramente llamó la atención de Antoine Lavoisier, llevándolo a estudiar a fondo la combustión hasta lograr desplazar esta teoría con sus experimentos realizados.
El padre del oxígeno y el adiós del flogisto
Los ensayos se realizaron con distintos dispositivos por parte de Lavoisier, lo que lo llevó a descubrir el oxígeno. Tras comprobar que el peso de algunos elementos inflamables cambiaba al entrar en contacto con el aire, entendió que había algo más.
Con más experimentos consiguió entender que el aire no era una sustancia simple. En este caso, estaba compuesto por un componente que impulsa tanto la combustión, así como la respiración, y otro que no influía en estos. No fue hasta 1779 que logró comunicar a la Real Academia de Ciencias de París el nacimiento del oxígeno como término y concepto.
Con el oxígeno descubierto, Antoine Lavoisier se basó en eliminar la creencia «imaginaria» del flogisto y darle un nuevo camino al universo de la química que, para ese entonces, se conocía. Es así como su trabajo con la combustión cambió la perspectiva de muchas cosas y se lograron más avances que se conocen en la actualidad.
Su trabajo se centró en impartir este conocimiento a los químicos jóvenes para que pudieran digerir la nueva química y erradicar el flogisto. Todo salió de la mejor manera y la revolución de la química sucedió y se mantiene hasta en la actualidad con su legado.
El despertar de un interés construyó una ley vigente
En el año 1679, Robert Boyle se encargó de hacer distintos ensayos que pudieran explicar la pérdida de masa que tenía lugar durante la combustión. Cada uno de estos experimentos solo logró indicar que existía un desbalance dentro de la masa, algo que descubrió Boyle luego de pesar varios metales.
Cien años después, Lavoisier se sentiría interesado en estas pruebas luego de haber presentado su trabajo de alumbrado público para París a los 21 años. Además de las distintas pruebas realizadas con los calorímetros, pudo determinar que en algunos metales ocurrían cambios luego de exponerlos al calor.
Todos los experimentos pudieron determinar de la mano de Lavoisier que la masa nunca varía cuando se toman en consideración cada una de las sustancias que intervienen en una reacción química. Es por eso que logró erradicar la teoría de flogisto, donde los gases dentro de un receptáculo con un metal calcinándose en el interior, juegan un papel fundamental.
En 1785, Antoine definió y dio el nacimiento a la Ley de Conservación de la Materia, igualmente conocida como Ley de conservación de la Masa. Esta se define de la siguiente manera:
«En los sistemas aislados, en el momento que ocurre alguna reacción química, la masa implicada dentro del sistema se encontrará constante. Es decir, que tanto la consumida por los reactivos, como la de los productos obtenidos debe ser la misma masa
»
Ejemplos comunes de la Ley de Conservación de Lavoisier
Para entender mejor de qué se trata esta ley que es también llamada Ley de Lomonósov – Lavoisier, mostraremos algunos ejemplos:
Ejemplo en la combustión con una vela de cera
En este ejemplo podemos determinar que al arder la vela no se logra perder ni ganar masa. Se determinó con este experimento que la masa de la cera y el oxígeno molecular (O2) que están en la ignición son los mismos que al finalizar.
Cuando la vela se apaga, el residuo es el dióxido de carbono (CO2) producido, el vapor de agua (H2O) y la cera sin quemarse, son una masa igual al inicio.
Ejemplo de peso con la oxidación del hierro
Gracias a esta ley se puede explicar cómo el óxido de hierro (Fe2O3) pesa más que el propio hierro en estado puro. La combinación de hierro (Fe) con oxígeno (O2) ocurre de la siguiente manera dentro del experimento.
4Fe + 3O2 → 2Fe2O3
Dentro de la ecuación química podemos observar cómo al oxidarse el hierro se logran combinar 3 moléculas de oxígeno con 4 partes de hierro. El resultado es el óxido de hierro, que tiene una masa igual que antes del proceso de oxidación, la misma cantidad de hierro y oxígeno.
Ejemplo con ácido clorhídrico
Dentro de este ejemplo podemos observar como el cloro y el hidrógeno, en estado gaseoso, logran combinarse teniendo la misma masa de su inicio. En la reacción se tiene hidrógeno gaseoso (H2) y cloro gaseoso (Cl2), dando paso al ácido clorhídrico de la reacción química.
H2 + Cl2 → 2HCl
Limitaciones dentro de esta Ley
Al hablar de la Ley de la Conservación de la Masa se debe entender que el trabajo hecho por Lavoisier fue realizado por aproximación. Dentro de algunos otros procesos no químicos, no necesariamente se va a tener la misma cantidad de masa en el resultado final.
Uno de estos ejemplos claros es cuando se produce una fusión nuclear, ya que existe una diferencia en la masa final de los productos. Es por ello que dentro de estos procesos ocurre un aporte de energía donde se involucra la velocidad de la luz. Dentro de estas reacciones la energía no se conserva, dando paso a la generalización de esta ley, conocida como equivalencia entre masa y energía.
Detalles de la muerte de Antoine Lavoisier
Claramente su vida era pública, además de haber estado desempeñando distintos cargos públicos, lo que lo llevó a tener enemigos. Uno de ellos fue el revolucionario Jean Paul Marat, quien en distintas oportunidades consiguió que detuvieran a algunos de sus colegas.
Su vinculación con Ferme Générale, que era un organismo privado de cobro de impuesto, lo llevó a estar detenido, algo que ocurrió en mayo de 1793. Esto despertó en distintas personalidades públicas un gran descontento, intentando salvarlo del juzgado, pero no lo lograron.
El presidente del tribunal, para el año 1794, al revisar cada uno de los trabajos de Antoine que fueron confiscados pronunció una de las frases más famosas. Ella expresa que la república no necesita científicos, ni químicos, algo que no va a detener el trabajo de la justicia.
Unas horas después, el 8 de mayo de 1794, este tribunal se encargó de condenar a la guillotina a este gran químico. Con solo 50 años moriría el padre de la química moderna y quien dejaría uno de los más grandes legados que se mantienen en la actualidad.
El primer libro de texto de química sigue vigente
El primer libro de química que fue publicado fue elaborado por Lavoisier, el cual tuvo origen en su primera edición para 1789. El Tratado Elemental de la Química llegó a marcar el nacimiento de la química moderna por los grandes avances que se encuentran en él.
Lavoisier se encarga en este texto de mencionar y explicar de forma detallada cada uno de los avances que estaba logrando dentro de esta ciencia. La misión, como lo mencionamos anteriormente, era que las nuevas generaciones de químicos pudieran comenzar a entender la nueva química que estaba siendo descubierta.
Este libro llega en el mismo año de la Revolución Francesa, dando pie a un gran cambio dentro de lo que era conocido hasta ese entonces. Sus descubrimientos más grandes hasta ese entonces se encuentran descritos en él, por lo que ahora mencionaremos algunos de ellos.
Descubrimientos de Lavoisier
Entre los descubrimientos más notables del padre de la química tenemos:
- Se encargó de definir a las sustancias puras como un «elemento», las cuales no se pueden descomponer en otras más sencillas.
- Con el nacimiento de un «elemento» logró nombrar a 33 sustancias nuevas, donde se incluyen al calor y la luz.
- La antes mencionada Ley de Conservación de la Masa, explicando detalladamente sus experimentos donde la materia y la energía no se crea, ni destruye.
- El nacimiento de la nomenclatura química que se emplea hoy en día
- Describe la hipótesis de la formación de algunos compuestos, teniendo como base a los elementos.
- Convierte a la química como una disciplina científica, con base en los experimentos e investigaciones científicas.
- Propone, en el texto, el método de análisis gravimétrico para estudiar y entender las reacciones químicas.
- Menciona detalles acerca de sus técnicas y métodos de experimentación que sin duda llevaron a Lavoisier a ser visto como padre de la química moderna.
El gramo como parte de su legado
Actualmente se conoce al gramo como el término de medición de masa más importante y al que se le añaden los prefijos del Sistema Internacional. Pero lo que pocos saben es que el químico Lavoisier también influyó en esta tarea de creación de un sistema de medición para la Francia revolucionaria.
Luis XVI de Francia se encargó de ordenar a los mejores científicos la tarea de construir un sistema de medición, dando como resultado al sistema de medición decimal. Tanto Antoine Lavoisier como los demás científicos dieron origen al «gravet», el cual equivalía a un gramo y al «bar» que equivalía a una tonelada.
Partiendo de esto, se comenzaron a utilizar los prefijos para poder determinar distintas cantidades de peso, como miligravet, centigravet, decigravet, en el caso de los gramos. En cambio, para los kilogramos se decía centigrave, decigrave y grave que era el kilogramo, y lo mismo con el centibar, decibar y bar que era la tonelada.
Luego de la Revolución Francesa, el grave, gravet y bar se unificaron en el término «gramo», como se le conoce en la actualidad. Este equivaldría a un gramo y se le añadirían los prefijos para las unidades grandes, miligramo, centigramo, decigramo, gramo, decagramo, hectogramo, kilogramo.
Claramente, Antoine Lavoisier es partícipe de uno de los sistemas más utilizados en la actualidad. A este Sistema Métrico Decimal lo definió el mismo Lavoisier como lo más grande y sublime que pueda tener el hombre en sus manos.
Reconocimientos que recibió Antoine Lavoisier
Algunos de los reconocimientos más destacados de Antoine Lavoisier son:
- Pertenece a la lista de 72 científicos que tienen su nombre inscrito en la Torre Eiffel, en París, Francia.
- Uno de los cráteres que tiene la luna fue bautizado con su nombre en su honor.
- Su nombre también sirvió para bautizar a un asteroide, específicamente el 6826.
Un lugar emblemático en su nombre
La Sociedad Francesa de Química junto a la ACS se encargó de crear el «Antoine Laurent Lavoisier: La Revolución Química». Este se convertiría en el lugar Emblemático Histórico Internacional dentro de la historia de la Química en la Real Academia de Ciencias en junio de 1999.
En el contenido de la placa con la que presentó el lugar la Academia de las Ciencias del Instituto de Francia se leen sus grandes aportes. Claramente lo aportado por Antoine sigue dando de qué hablar, dando paso a los grandes estudios que se siguen realizando hoy con las nuevas tecnologías.
Además de esto, dos décadas después de la muerte de Antoine Lavoisier, surge la teoría atómica de John Dalton y la hipótesis de Amedeo Avogadro. Una respuesta inmediata a lo que se estaba consiguiendo y que marcaría el inicio contundente de las bases de la química moderna que conocemos.
Referencias:
https://es.wikipedia.org/wiki/Antoine_Lavoisier
https://es.wikipedia.org/wiki/Tratado_elemental_de_qu%C3%ADmica
https://es.wikipedia.org/wiki/Marie-Anne_Pierrette_Paulze
https://www.lifeder.com/aportaciones-de-lavoisier/












0 comentarios